
Terapia Combinada con Doxazosina y Finasterida en el Tratamiento de la Hiperplasia Prostática Benigna (HPB)
Introducción
La hiperplasia prostática benigna (HPB) es una de las patologías urológicas más frecuentes en hombres mayores de 50 años. Se caracteriza por un crecimiento no maligno de la glándula prostática, que ocasiona síntomas del tracto urinario inferior (LUTS). El tratamiento farmacológico más utilizado incluye los bloqueadores alfa-adrenérgicos, como la doxazosina, y los inhibidores de la 5-alfa-reductasa (5-ARI), como el finasteride. Estudios recientes han demostrado que la terapia combinada con ambos fármacos mejora la eficacia clínica y reduce la progresión de la enfermedad.
"
El riesgo de retención urinaria aguda o intervención quirúrgica se redujo con la finasterida sola o con la terapia combinada, pero no con la doxazosina sola, en comparación con el placebo.”
Mecanismo de acción y Evidencia clínica de la terapia combinada
Finasterida (5-α-reductasa tipo 2)
Bloqueo endocrino primario
Finasterida inhibe la conversión de testosterona en dihidrotestosterona (DHT) dentro del estroma prostático, reduciendo el ligando disponible para el receptor androgénico (AR). Al caer la concentración de DHT, disminuye el complejo DHT-AR que migra al núcleo y se une a los elementos de respuesta androgénica (ARE), deteniendo la transcripción de genes diana como PSA (KLK3), FKBP5 y enzimas lipogénicas [3].
Reprogramación transcriptómica del epitelio transicional
En el ensayo MTOPS, la administración de finasterida alteró > 400 genes en biopsias de zona transicional. Predominó la represión de:
- vías de respuesta androgénica y estrogénica,
- metabolismo de ácidos grasos (FA-synthase, SCD) y aminoácidos,
- genes inmunorreguladores (Figura 1) [2].
Figura 1 Resumen del número de genes significativos que se superponen entre diferentes tratamientos (Un valor de FDR menor a 0.05 (FDR < 0.05) significa que, de todos los genes o vías declarados como significativos, se espera que menos del 5% sean falsos positivos).
SC1 consistía principalmente en pacientes tratados con finasterida o terapia combinada, mientras que SC2 estaba dominado por pacientes tratados con doxazosina o placebo. El cluster SC1 (86,8 % de los tratados) exhibió silenciamiento transcripcional y 90,1 % de éxito clínico; el cluster SC2 apenas modificó su perfil y concentró la resistencia (55,5 %) [2].
Compensación y resistencia molecular
En SC2 se mantuvo elevada la expresión basal de cinasas ricas en dominios ATP-binding y de FKBP5 [2]. FKBP5 puede heterodimerizar con AR y potenciar su actividad pese a la caída de DHT, además de activar PI3K-Akt-mTOR y MAPK, rutas que sostienen la proliferación estromal aun con 5-ARI [2].
Doxazosin (α1-bloqueante de núcleo quinazolina)
Efecto dinámico inmediato
El fármaco antagoniza los receptores α1A/α1D abundantes en fibras lisas del cuello vesical y estroma, impidiendo la señal Gq/PLC/IP₃/Ca²⁺ y relajando el componente dinámico de la obstrucción [1].
Acciones paracrinas antimitóticas y antifibróticas
El estudio murino con testosterona-propionato demostró que doxazosin (10 mg/kg) suprime:
• TGF-β1 y su receptor TGFBR2,
• fosforilación nuclear de Smad2/3,
• marcadores de EMT (↓ N-cadherina, vimentina, fibronectina, α-SMA; ↑ E-cadherina),
• producción de PSA [3].
La consecuencia es regresión del índice prostático, disminución de colágeno (tinción de Masson) y apoptosis del estroma. In vitro, en fibroblastos WPMY-1, doxazosin 1-50 µM revierte el EMT inducido por testosterona y frena la proliferación estromal [3].
Independencia del receptor α1
Aunque el bloqueo adrenérgico explica la relajación muscular, la inhibición de TGF-β/Smad y la inducción apoptótica se producen incluso en células carentes de α1-AR, sugiriendo que el anillo quinazolina desencadena vías de muerte celular (caspasa-3, TNF-α/FADD) y suprime la señal profibrótica de manera directa [3].
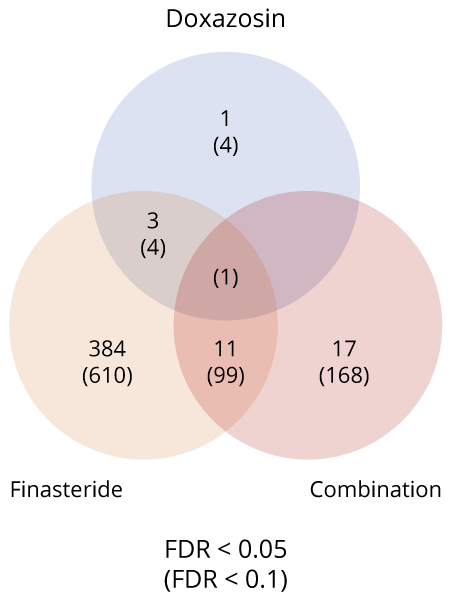
Figura 1 ilustra que la finasterida tiene un impacto mucho más amplio en la expresión génica del tejido de la zona transicional de la próstata que la doxazosina, y que la terapia combinada comparte una parte de este perfil genético alterado con la finasterida, lo que resalta la contribución dominante de la finasterida a los cambios moleculares observados en la terapia combinada.
Convergencia sobre EMT, fibrosis y metabolismo
EMT como nudo patogénico
El EMT transforma epitelio en estroma miofibroblástico, impulsando el crecimiento prostático y la rigidez glandular. Finasterida ataca el gatillo hormonal (AR), mientras doxazosin desarticula el efector profibrótico (TGF-β1/Smad). Ambos restauran E-cadherina y reducen N-cadherina/vimentina, pero lo hacen por vías distintas y complementarias [2, 3].
Metabolismo lipídico y energético
La supresión finasterida-dependiente de genes lipogénicos y de oxidación de ácidos grasos en SC1 sugiere que la próstata hiperplásica necesita un alto flujo anabólico para sostener su crecimiento; el fármaco lo corta de raíz [2]. Doxazosin, al inducir apoptosis estromal, reduce la demanda biosintética y puede reforzar este freno metabólico.
Sinergia clínica y superación de la resistencia
Eficacia combinada en MTOPS
- Los análisis iniciales del estudio MTOPS (Medical Therapy of Prostatic Symptoms), un ensayo prospectivo, aleatorizado, doble ciego y controlado con placebo, encontraron que la doxazosina y la finasterida eran eficaces en un subconjunto de pacientes.
- La combinación de doxazosina y finasterida disminuyó la gravedad de los STUI y el riesgo de retención urinaria más que cualquiera de los dos medicamentos solos.
- La terapia combinada redujo el riesgo de progresión clínica general a 1.5 por cada 100 personas-años, lo que es menor que el placebo o cualquiera de las monoterapias (p < 0.001).
- El riesgo de retención urinaria aguda o intervención quirúrgica se redujo con la finasterida sola o con la terapia combinada, pero no con la doxazosina sola, en comparación con el placebo [2].
Justificación mecanística
- Finasterida reduce el volumen estático al suprimir DHT-AR-ARE.
- Doxazosin brinda alivio sintomático inmediato, induce apoptosis estromal y bloquea la vía TGF-β/Smad, previniendo la fibrosis que limita la penetración y eficacia de 5-ARI.
- En presencia de quinasa/ATP-binding elevada (marcador de resistencia), la acción adrenolítica y antifibrótica de doxazosin compensa la persistencia de AR activo [2, 3].
Implicaciones terapéuticas
• La combinación es racional en próstatas voluminosas o con fibrosis incipiente, donde la vía TGF-β está hiperactiva.
• El cribado de FKBP5, cinasas ATP-binding y volumen TZ basal podría identificar pacientes que se beneficiarían precozmente del abordaje dual [2].
• El desarrollo de inhibidores específicos de FKBP5 o moduladores de MAPK/PI3K-Akt podría revertir la resistencia a 5-ARI sin necesidad de añadir cirugía [2].
Bases moleculares de la combinación
La combinación de ambos fármacos actúa de forma complementaria: mientras la doxazosina mejora rápidamente los síntomas irritativos y obstructivos, el finasteride reduce el crecimiento prostático al atacar la raíz hormonal de la enfermedad. A nivel molecular, la inhibición de la DHT limita la proliferación celular, y el bloqueo α1 reduce tanto la contracción como la señalización fibrótica de la próstata.
Conclusiones y Recomendaciones
La terapia combinada con doxazosina y finasteride representa una estrategia eficaz en pacientes con HPB moderada a grave, especialmente en aquellos con próstatas voluminosas y alto riesgo de progresión. Se recomienda individualizar el tratamiento, evaluando tanto la sintomatología como el tamaño prostático y el perfil de efectos adversos. El monitoreo clínico es fundamental para optimizar los resultados y minimizar riesgos.
Referencias
- Sitar, N.A. (2024). Pharmacological Management of Benign Prostatic Hyperplasia: Reviewing Current and Emerging Drugs. Eurasian Experiment Journal of Public Health, 7(2), 95–99.
- Choi, H.Y., Torkko, K.C., Lucia, M.S., Mozhui, K., Choi, W.Y., Clark, P.E., & Fowke, J.H. (2024). Change in prostate tissue gene expression following finasteride or doxazosin administration in the medical therapy for prostatic symptoms (MTOPS) study. Scientific Reports, 14:19364.
- Li, Y.D., Tu, B.H., Wang, Z.T., Shao, Z.C., et al. (2024). Doxazosin Attenuates Development of Testosterone Propionate-induced Prostate Growth by regulating TGF-β/Smad Signaling Pathway, Prostate-specific Antigen Expression and Reversing Epithelial-Mesenchymal Transition in Mice and Stroma Cells. Current Molecular Pharmacology, 17:e18761429315125.






















